
पोटेशियम क्या है? इलेक्ट्रॉनिक विन्यास, परमाणु संख्या और द्रव्यमान
पोटेशियम एक रासायनिक तत्व है जो तत्वों की आवर्त सारणी में 19 वें नंबर पर है। पोटेशियम अपने निकटतम रासायनिक तत्व सोडियम की तरह ही प्राचीन काल से जाना जाता है और विभिन्न क्षेत्रों में उपयोग किया जाता है।
पोटेशियम गुण |
|
|
पोटेशियम का प्रतीक |
K |
|
पोटेशियम परमाणु संख्या |
19 |
|
परिवार |
अलकाली धातु |
|
समूह |
1 |
|
अवधि |
4 |
|
खंड |
s |
|
वॉल्यूमेट्रिक मास |
0.89 ग्राम सेमी-3 |
|
कठोरता |
0.4 |
|
रंग |
चांदी सफेद |
पोटेशियम के परमाणु गुण |
|
|
पोटेशियम परमाणु द्रव्यमान |
39.0983 u |
|
परमाणु का आधा घेरा |
220 pm |
|
पोटेशियम का इलेक्ट्रॉनिक विन्यास |
[Ar] 4s1 |
|
ऊर्जा स्तर द्वारा इलेक्ट्रॉन |
2 | 8 | 8 | 1 |
|
ऑक्साइड |
मजबूत आधार |
पोटेशियम के भौतिक गुण |
|
|
साधारण अवस्था |
ठोस |
|
पोटेशियम गलनांक |
63.5 डिग्री सेल्सियस |
|
क्वथनांक |
759 डिग्री सेल्सियस |
यह भी जानें - नियॉन का इलेक्ट्रॉनिक विन्यास क्या होता है?
पोटेशियम का प्रतीक क्या है?
हालांकि पोटेशियम की स्पेलिंग P से शुरू होती है लेकिन पोटेशियम का प्रतीक K होता है। इसका प्रतीक "K" को जर्मन नाम "कैलियम" (Kalium) से लिया गया है। इस तत्व के खोजकर्ता द्वारा 1807 में पोटेशियम नाम प्रस्तावित किया गया था।
अब हम इस आर्टिकल में जानेंगे कि पोटेशियम की खोज किसने की थी और पोटेशियम का इलेक्ट्रॉनिक विन्यास क्या होता है।
पोटेशियम की खोज किसने की?
कुछ यौगिकों, जैसे पोटाश, को बहुत पुराने समय से जाना जाता है और उपयोग किया जाता है, लेकिन पोटेशियम को 1807 तक एक तत्व के रूप में पहचाना नहीं गया था|
सन 1807 में ब्रिटिश रसायनज्ञ हम्फ्री डेवी ने पिघला हुआ पोटेशियम हाइड्रॉक्साइड का इलेक्ट्रोलिसिस किया और इस अज्ञात धातु को प्राप्त किया। इसका अर्थ है की पोटेशियम की खोज हम्फ्री डेवी (Humphry Davy) ने की थी।
पोटेशियम इलेक्ट्रोलिसिस द्वारा पृथक की गयी पहली धातु थी। विद्युत प्रवाह के प्रभाव में एक रासायनिक तत्व के अपघटन को इलेक्ट्रोलिसिस कहा जाता है।
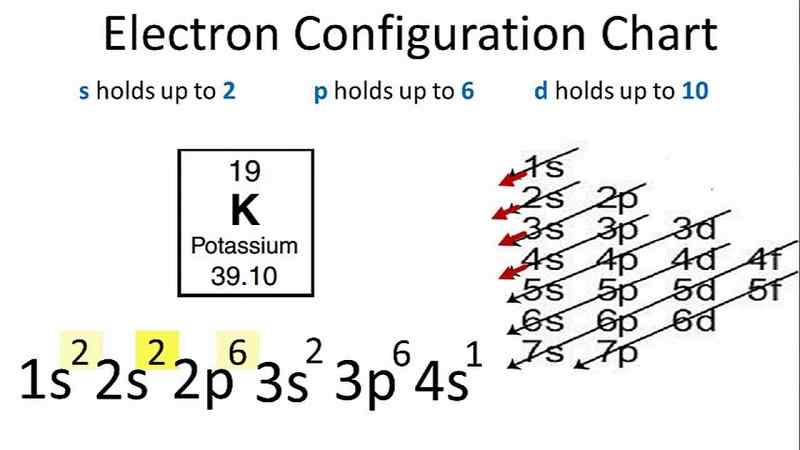
पोटेशियम (K) का इलेक्ट्रॉनिक विन्यास
पोटेशियम का परमाणु भार 39.098 u और परमाणु क्रमांक 19 है और पोटेशियम का इलेक्ट्रॉनिक विन्यास 1s2 2s2 2p6 3s2 3p6 4s1 होता है। इसके अलावा आप पोटेशियम इलेक्ट्रॉन विन्यास को संक्षिप्त रूप में लिख सकते हैं- [Ar] 4s1 |
पोटेशियम परमाणु (K) और Cl-2 , Sc+2 , Ti+3 , V+4 , Mn+6 का इलेक्ट्रॉनिक विन्यास समान होता है। पोटेशियम में कुल 19 इलेक्ट्रॉन होते हैं, हम इलेक्ट्रॉन कोशों को निम्न प्रकार से भरते हैं:
-
1s- उप-स्तर (सबलेवल) में 2 इलेक्ट्रॉन
-
2s- उप-स्तर में 2 इलेक्ट्रॉन
-
2p- उप-स्तर में 6 इलेक्ट्रॉन
-
3s- उप-स्तर में 2 इलेक्ट्रॉन
-
3p- उप-स्तर में 6 इलेक्ट्रान
-
4s- उप-स्तर में 1 इलेक्ट्रॉन
Important point
-
पोटेशियम आयन K+ का इलेक्ट्रॉनिक विन्यास : 1s2 2s2 2p6 3s2 3p6 4s0
-
पोटेशियम आयन K- इलेक्ट्रॉन विन्यास: 1s2 2s2 2p6 3s2 3p6 4s2
पोटेशियम इलेक्ट्रॉन विन्यास का आरेख
पोटेशियम की उपस्थिति
भूपर्पटी में पोटेशियम प्रचुर मात्रा में उपस्थित तत्व है। यह पृथ्वी की भूपर्पटी के कुल वजन का 2.58% का प्रतिनिधित्व करता है, जिससे यह पृथ्वी पर पाए जाने वाले 7 सबसे प्रचुर तत्वों में से एक है।
हालांकि, पोटेशियम एक मूल तत्व नहीं है यह शुष्क प्रक्रिया में पोटेशियम हाइड्रॉक्साइड के इलेक्ट्रोलिसिस द्वारा प्राप्त किया जाता है। इसके अलावा यह वह प्रक्रिया है जिसे सर डेवी ने खोजा और इस्तेमाल किया।
पोटेशियम से बने कई खनिज हैं जैसे:
-
कार्नेलाइट- KMgCl3 6H2O
-
लैन्गबेनाइट- K2 Mg2 (SO4) 3
-
पॉलीहैलाइट- K2 Ca2 Mg (SO4 ) 4 2H2O
-
और सिल्विन- KCl
पोटेशियम के भौतिक और रासायनिक गुण
पोटेशियम के भौतिक गुण
-
यह भूरे रंग कि एक धातु है। पोटेशियम बहुत नरम, तन्य और बहुत प्रतिक्रियाशील है। यह सबसे कम करने वाली धातुओं में से एक है।
-
यह धातु के रूप में आता है जिसे इलेक्ट्रोलिसिस द्वारा प्राप्त किया जा सकता है, लेकिन यह प्रकृति में मौजूद नहीं है।
-
पोटेशियम एक बहुत ही हल्का, चांदी जैसा सफेद क्षार धातु है, और यह पानी के साथ बहुत प्रतिक्रियाशील है।
-
पौधों के लिए, पोटेशियम आयन परासरण दाब बनाए रखने और पौधों की वृद्धि जैसी प्रक्रियाओं में महत्वपूर्ण भूमिका निभाता है।
पोटेशियम के रासायनिक गुण
पोटेशियम आयन
पोटेशियम आयन, सूत्र K+ के साथ , धनात्मक एकपरमाणुक आयन होते हैं| इन्हे धनायन भी कहा जाता है, जिसमें 1 अतिरिक्त धनात्मक आवेश होता है।
पोटेशियम यौगिक
सभी पोटेशियम यौगिक आयनिक होते हैं:
-
पोटेशियम हाइड्रॉक्साइड (KOH), पोटेशियम आयनों के संयोजन से बनने वाला एक आयनिक यौगिक है, अर्थात K+ और OH-। यह पानी में घुलकर "पोटाश" नामक एक बुनियादी जलीय घोल बनाता है।
-
पोटेशियम क्लोराइड (KCl) पोटेशियम आयनों और क्लोराइड आयनों से बना होता है। इसे समुद्री जल से निकाला जा सकता है या पौधे की राख से प्राप्त किया जा सकता है। इसका स्वाद रसोई के नमक की तरह ही होता है, यानी सोडियम क्लोराइड। इसका रक्तचाप पर कोई प्रभाव नहीं पड़ता है इसलिए इसे नमक जगह पर उपयोग किया जा सकता है।
पोटेशियम के समस्थानिक
पोटेशियम के 24 समस्थानिक होते हैं, जिनकी द्रव्यमान संख्या 32 और 55 के बीच होती है। इन समस्थानिकों के अलावा, पोटेशियम में 4 परमाणु समावयव भी होते हैं।
हालाँकि, प्राकृतिक पोटेशियम केवल इसके 3 समस्थानिकों द्वारा ही दर्शाया जाता है:
-
K 39, प्राकृतिक पोटेशियम के 93.26% का प्रतिनिधित्व करता है
-
K 41, प्राकृतिक पोटेशियम के 6.73% का प्रतिनिधित्व करता है
-
और एक रेडियोआइसोटोप, K 40, जिसका आधा जीवन (half life) बहुत लंबा है, जो प्राकृतिक पोटेशियम के 0.01167% का प्रतिनिधित्व करता है।
यह ध्यान रखना महत्वपूर्ण है कि K 40, बीटा+ और बीटा- विकिरण का उत्पादन, क्षय करने में सक्षम है।
पोटेशियम के उपयोग
पोटेशियम के कुछ सामान्य उपयोग नीचे दिए गए हैं:
-
पोटेशियम का उपयोग कई रासायनिक प्रतिक्रियाओं में किया जाता है, थर्मल कंडक्टर बनाने के लिए सोडियम और पोटेशियम के मिश्र धातु का प्रयोग किया जाता है।
-
यह मुख्य रूप से पोटाश, या पोटेशियम हाइड्रॉक्साइड जैसे यौगिकों के रूप में पाया जाता है, जो डिटर्जेंट के निर्माण में उपयोग किया जाता है।
-
कृषि में, पोटेशियम का उपयोग एनपीके (NPK) उर्वरक के रूप में किया जा सकता है।
-
पोटेशियम क्लोराइड का उपयोग हृदय की समस्याओं के इलाज में भी किया जाता है।
-
इसका उपयोग आतिशबाज़ी के पटाखों में भी किया जाता है।
स्वास्थ्य पर पोटेशियम के प्रभाव
-
हमारे दैनिक भोजन में विशेष रूप से केले में पोटेशियम पाया जाता है। हमारे शरीर के विकास के लिए आवश्यक पोटेशियम की एक निश्चित मात्रा ही होती है, इसके कारण किडनी और दिल की बीमारी की समस्या हो सकती है।
-
पोटेशियम शरीर के विभिन्न हिस्सों जैसे कि आंख, नाक, गले बल्कि फेफड़ों में जलन पैदा कर सकता है, जिससे छींक और खांसी हो सकती है।
-
पोटेशियम के अत्यधिक संपर्क के गंभीर परिणाम हो सकते हैं, क्योंकि इससे फेफड़ों में तरल पदार्थ जमा हो सकता है या बहुत गंभीर जलन भी हो सकती है।
पूछे जाने वाले महत्वपूर्ण प्रश्न
पोटेशियम कि ऑक्सीकरण अवस्था क्या हैं?
पोटेशियम परमाणुओं की ऑक्सीकरण अवस्था 1, -1 होती है।
पोटेशियम की संयोजकता कितनी होती है?
यौगिकों में रासायनिक बंधों की संख्या, जिसके द्वारा मुक्त किया गया परमाणु अन्य परमाणुओं से जुड़ा होता है संयोजकता कहलाती है, पोटेशियम परमाणु संयोजकता 1 प्रदर्शित करते हैं।
पोटेशियम की आयनीकरण ऊर्जा क्या है?
पोटेशियम की आयनन ऊर्जा E o = 419 kJ/mol है।
पोटेशियम तत्व की चार क्वांटम संख्याएं क्या हैं?
क्वांटम संख्याएँ विन्यास में अंतिम इलेक्ट्रॉन द्वारा निर्धारित की जाती हैं। पोटेशियम के संयोजकता इलेक्ट्रॉन की चार क्वांटम संख्याएँ N = 4, L = 0, Ml = 0, Ms = ½ हैं।
Related Articales
Recently Posted
-
भगवान गौतम बुद्ध जीवन परिचय | Gautam Buddha in Hindi
December 15, 2022. -
कार्बन के अपररूप Allotropes of Carbon in Hindi
November 5, 2022. -
मिश्र धातु किसे कहते हैं? उपयोग, नाम, गुण Alloy in Hindi
July 27, 2022. -
गलनांक किसे कहते हैं? परिभाषा, उदाहरण Melting Point in Hindi
July 20, 2022. -
परिमाप किसे कहते हैं? Perimeter in Hindi
July 19, 2022.




