
अष्टक नियम क्या है? उदाहरण व अपवाद Octet rule in Hindi
अष्टक नियम क्या है? | Octet rule in Hindi
अष्टक नियम रसायन विज्ञानं का सबसे महत्वपूर्ण नियमों में से एक है, जिसमें कहा गया है कि परमाणु इस तरह से गठबंधन करना पसंद करते हैं कि प्रत्येक परमाणु के वैलेंस शेल में 8 इलेक्ट्रॉन हों।
इस नियम के अनुसार परमाणु आपस में इस प्रकार से जुड़ते हैं कि प्रत्येक परमाणु अपनी संयोजकता कोश में आठ इलेक्ट्रॉनों से घिरा रहता है, इसलिए इसे अष्टक नियम (Octet rule in Hindi) कहा जाता है।
यह नियम 1916 में गिल्बर्ट लुईस (Gilbert Lewis) और वाल्थर कोसल (Walther Kossel) दोनों द्वारा एक साथ प्रकाशित किया गया था। इसके अनुसार आदर्श गैसें बहुत स्थिर होती हैं और सभी आदर्श गैसों की विशेषता यह है कि उनके अंतिम कोश 8 इलेक्ट्रॉनों से भरे होते हैं| हीलियम इसका अपवाद है जिसके अंतिम कोश में 2 इलेक्ट्रान होते हैं।
यह नियम बताता है कि, पूर्ण-शेल इलेक्ट्रॉनिक विन्यास को प्राप्त करने के लिए परमाणु रासायनिक बंधन बनाकर इलेक्ट्रॉनों का आदान प्रदान करते हैं।
अष्टक नियम के उदाहरण | Examples of Octet rule in Hindi
अष्टक नियम मुख्य रूप से प्रतिनिधि तत्वों (Representative Elements) पर लागू होता है, जो कि आवर्त सारणी के s और p ब्लॉक में उपस्थित हैं। यह नियम कार्बन, नाइट्रोजन, ऑक्सीजन और हैलोजन युक्त यौगिकों पर लागू होता है, और कुछ अपवादों के साथ p ब्लॉक के अन्य तत्वों पर लागू होता है। हालांकि, अधिकांश संक्रमण धातुएं ऑक्टेट नियम का पालन नहीं करती हैं।
अष्टक नियम के कुछ उदाहरण निम्नलिखित है:
कार्बन डाइऑक्साइड (CO2)
नीचे के चित्र में कार्बन डाइऑक्साइड की लुईस संरचना में आप देख सकते हैं कि, बीच में उपस्थित कार्बन और दोनों ऑक्सीजन परमाणु ऑक्टेट नियम (Ashtak niyam) का पालन कर रहे हैं।
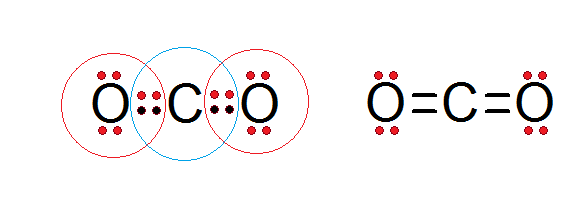
कार्बन अपने 4 वैलेंस इलेक्ट्रॉनों और प्रत्येक ऑक्सीजन के दो इलेक्ट्रॉनों से घिरा हुआ है, जो C=O डबल बॉन्ड बनाने में मदद करते हैं, जबकि प्रत्येक ऑक्सीजन अपने 6 इलेक्ट्रॉनों और कार्बन के2 इलेक्ट्रॉनों से घिरा होता है।
नियोपेंटेन (C5H12 )
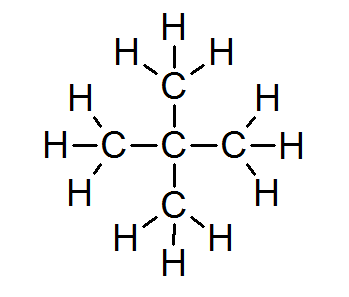
उपरोक्त चित्र से देखा जा सकता है कि प्रत्येक कार्बन परमाणु अपने चार इलेक्ट्रॉनों को 4 पड़ोसी हाइड्रोजन परमाणुओं के साथ साझा कर रहा है, जिनमें से प्रत्येक हाइड्रोजन अपने इलेक्ट्रॉनों में से एक को 4 सरल सहसंयोजक बंधन बनाने के लिए योगदान दे रहा है जो उन्हें एक साथ रखता है।
इस कारण से, प्रत्येक कार्बन परमाणु अष्टक नियम का अनुपालन करते हुए 8 संयोजकता इलेक्ट्रॉनों से घिरा रहता है।
कार्बन मोनोऑक्साइड (CO)
कार्बन मोनोऑक्साइड एक अन्य आणविक यौगिक है जिसमें ऑक्टेट नियम को पूरा करने के लिए ऑक्सीजन और कार्बन एक सहसंयोजक बंधन बनाने वाले इलेक्ट्रॉनों को साझा करते हैं।
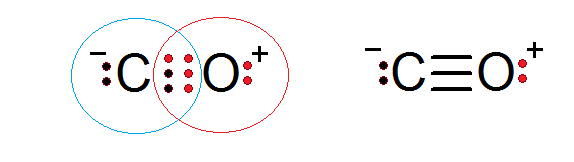
उपरोक्त चित्र से हम देख सकते हैं कि, कार्बन दो इलेक्ट्रॉनों और ऑक्सीजन 4 इलेक्ट्रॉनों का योगदान देता है, जो उन्हें जोड़ने वाले ट्रिपल सहसंयोजक बंधन बनाने के लिए आवश्यक 6 इलेक्ट्रॉनों को पूरा करता है। दो परमाणुओं में से प्रत्येक में असहभाजित इलेक्ट्रॉनों की एक अतिरिक्त जोड़ी होती है जो प्रत्येक अष्टक का निर्माण करती है।
नाइट्रेट आयन (Na3- )
अष्टक नियम आयनों के लिए भी मान्य है। नाइट्रेट आयन में एक नाइट्रोजन परमाणु होता है, जो 3 ऑक्सीजन परमाणुओं से घिरा होता है।
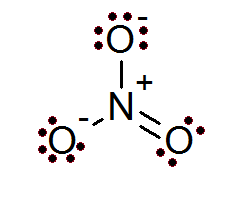
उपरोक्त चित्र से हम देख सकते हैं कि, सभी परमाणुओं में अपना अष्टक भरा होता है, दो ऑक्सीजन में एक ऋणात्मक आवेश होता है जबकि नाइट्रोजन का एक धनात्मक आवेश होता है, जिसके परिणामस्वरूप नाइट्रेट आयन का शुद्ध आवेश -1 होता है।
सोडियम क्लोराइड (NaCl)
आयनिक यौगिक बनाने के लिए इलेक्ट्रॉनों का आदान-प्रदान भी अष्टक नियम के एक सामान्य उदाहरण हैं।
क्लोरीन और सोडियम से जब सोडियम क्लोराइड बनता है, तो यह दो परमाणुओं से शुरू होता है, जो ऑक्टेट नियम का पालन नहीं करते हैं, क्योंकि सोडियम में एक इलेक्ट्रॉन अधिक होता है, और क्लोरीन में अपना ऑक्टेट पूरा करने के लिए एक की कमी होती है।
फिर, सोडियम अपना एक इलेक्ट्रॉन क्लोरीन को देता है, 8 इलेक्ट्रॉनों से घिरा हुआ धनायन छोड़ देता है और बदले में क्लोराइड आयन बनाकर ऑक्टेट को क्लोरीन में पूरा करता है।
[ यह भी जानिए- राउल्ट का नियम क्या है? ]
अष्टक नियम के अपवाद
जिस तरह बड़ी संख्या में ऐसे यौगिक होते हैं जिनमें सभी परमाणु अष्टक नियम को पूरा करते हैं, उसी प्रकार परमाणुओं के कई उदाहरण हैं जो ऐसा नहीं करते हैं। जिन्हे अष्टक नियम का अपवाद कहा जाता है|
कुछ 8 से कम इलेक्ट्रॉनों से घिरे होते हैं, जो उन्हें इलेक्ट्रॉन-कमी वाली श्रेणियां बनाते हैं, जबकि कई अन्य यौगिक आठ से अधिक इलेक्ट्रॉनों से घिरे होते हैं, इसको विस्तारित ऑक्टेट कहा जाता है या इसे हाइपरवैलेंट परमाणु कहा जाता है।
इलेक्ट्रॉन की कमी वाली यौगिकों के उदाहरण:-
बोरेन (BH3 )
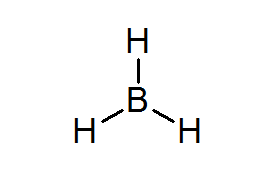
यह यौगिक इलेक्ट्रॉन की कमी वाले यौगिकों का एक विशिष्ट उदाहरण है। केंद्रीय परमाणु में ऑक्टेट नियम को पूरा करने के लिए न तो बोरॉन और न ही इसके आसपास के हाइड्रोजन में पर्याप्त इलेक्ट्रॉन होते हैं।
एल्युमिनियम ट्राइक्लोराइड (AlCl3)
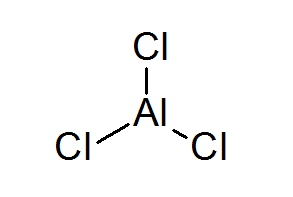
एल्युमिनियम ट्राइक्लोराइड, लुईस एसिड का एक और उदाहरण है जो अपने रासायनिक गुणों के कारण अष्टक नियम को पूरा नहीं करता है|
हाइपरवैलेंट यागिकों के उदाहरण
सल्फर हेक्साफ्लोराइड (SF6 )
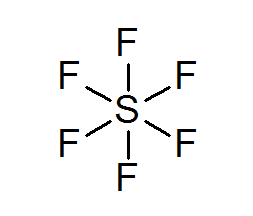
विस्तारित ऑक्टेट का एक विशिष्ट उदाहरण एसएफ 6 है , जिसे आमतौर पर फ्लोरीन परमाणुओं के साथ 6 सरल सहसंयोजक बंधनों के साथ केंद्रीय सल्फर के रूप में दर्शाया जाता है। इस मामले में, सल्फर 8 के बजाय 12 वैलेंस इलेक्ट्रॉनों से घिरा हुआ है, इस प्रकार ऑक्टेट नियम का उल्लंघन करता है।
फॉस्फोरस पेंटाक्लोराइड (PCl5)
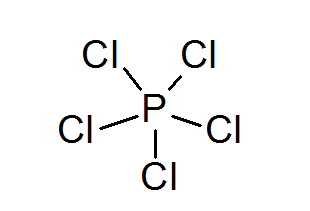
फॉस्फोरस भी विस्तारित ऑक्टेट के साथ यौगिक बना सकता है, इस तरह से यह 10 इलेक्ट्रॉनों से घिरा हुआ है।
[ यह भी जानिए- हेनरी का नियम क्या है? ]
FAQs
अष्टक का नियम किसने दिया था?
जर्मन रसायनज्ञ वाल्थर कोसेल और अमेरिकी रसायनज्ञ गिल्बर्ट लुईस ने 1916 में अलग-अलग यह नियम प्रकाशित किया था।
अष्टक नियम के उदाहरण क्या हैं?
इस नियम के प्रमुख उदाहरण कार्बन डाइऑक्साइड, सोडियम क्लोराइड, नियोपेंटेन, कार्बन मोनोऑक्साइड, और नाइट्रेट आयन हैं |
Related Articales
Recently Posted
-
भगवान गौतम बुद्ध जीवन परिचय | Gautam Buddha in Hindi
December 15, 2022. -
कार्बन के अपररूप Allotropes of Carbon in Hindi
November 5, 2022. -
मिश्र धातु किसे कहते हैं? उपयोग, नाम, गुण Alloy in Hindi
July 27, 2022. -
गलनांक किसे कहते हैं? परिभाषा, उदाहरण Melting Point in Hindi
July 20, 2022. -
परिमाप किसे कहते हैं? Perimeter in Hindi
July 19, 2022.




